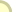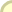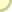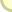|
 |
 |
 |
חזרה3 |
מה כבר ניתן לחדש לתלמיד אודות מלח בישול? הרי כל אחד יודע כי זהו נתרן כלורי, אשר נמס היטב במים ויוצר גבישים קוביים חסרי צבע. ובכל זאת…
נתחיל מצורת הגביש. ברוב החומרים היא תלויה לא פעם בתנאי הגידול של גבישים. כשמגבשים נתרן כלורי מתמיסתו הרוויה בטמפרטורה 15°C-, נוצרים מחטים או לוחיות בצורת משושה של דיהידרט NaCl*2H2O. לגבישים אלה קוראים הידרוהליט - "מלח מימי" (מהמילים היווניות hydro - מים, halos - מלח). בארצות הצפון ניתן למצוא הידרוהליט באגמים מלוחים בחורף קר. כשמחממים את הלוחיות הן מאבדות את שקיפותן ומתפרקות לקוביות קטנטנות של NaCl רגיל.
נדירים הרבה יותר הם הגבישים הגדולים בצורת משושה של קריוהליט - "מלח קרחי" (ביוונית kryos - קור, קרח), אשר נוצרים בטמפ' 23°C-.
ניתן לשנות את צורת הגביש לא רק ע"י שינוי טמפ' גיבוש. ידוע שתוספת חומרים אחדים לתמיסת מלח יכולה לשנות את צורת הגבישים שלו. כדי לגדל גבישי מלח בישול בצורה אוקטאהדרית, מספיק להוסיף לתמיסתו שיתנן.
גם המבנה של הגבישים הרגילים של מלח בישול אינו פשוט כל כך: לעתים קרובות קיים חלל בתוך הגביש ובו נשארת תמיסה שממנה מתגבש המלח. ככל שהגביש הוא גדול יותר, כך הוא מכיל יותר תמיסה, לפעמים עד 3% ממסתו. אם נופלים גבישים גדולים יחסית של מלח בישול על משטח חם (למשל, מחבט לוהט) הם מתפקעים ומנתזים לכל עבר: המים הרותחים "מפוצצים" את הגבישים מבפנים.
לא רק צורת הגביש ניתנת לשינוי, אלא גם צבעו. איך לקבל גבישי מלח בישול בצבע כחול? מספיק להוסיף למלח מעט נתרן מתכתי ולחמם בחום גבוה (ללא חמצן האוויר, כמובן!). בטמפרטורות גבוהות (600-700°C) חלק של הנתרן מותך, וחלקו - הופך לגז. הנתרן מתמוסס במלח מוצק, וזה הגורם לצביעת הגבישים.
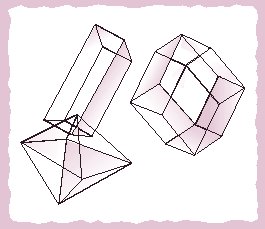
גבישי מלח בישול:
למטה בצד שמאל: מודל לגביש בצורת אוקטאהדר שהתגבש
מתמיסת NaCl המכילה Pb(NO3)2 0.1% ו- H2SO4 0.5%;
למעלה בצד שמאל: מודל של גביש של מלח מאובן;
מימין: מודל של רומבודודקאהדר שהתגבש עקב שינויים
תקופתיים בטמפרטורה של תמיסה רוויה.
תהליך ההמסה של מתכת במלח מעניין מאוד. בכל גביש תמיד יש פגמים - מקומות שחסרים בהם אניונים או קטיונים מסיבה כלשהי. בטמפרטורות גבוהות אטומי הנתרן עוברים יינון: הם מאבדים אלקטרונים ערכיים שלהם והופכים לקטיונים של נתרן +Na. קטיונים ואלקטרונים משלימים את מבנה הגביש - יוני נתרן במקומות שבהם חסרים קטיונים, אלקטרונים - במקומות שבהם חסרים אניונים של כלור Cl. נקודה שבה נמצא האלקטרון במקום אניון, נקראת F-מרכז (F-center, מהמילה גרמנית Farbe - צבע). במצב של חוסר זעיר מאוד של אניוני כלור - כאשר לכל 1000 יוני כלור יש מקסימום מרכז F אחד, סמ"ק אחד של גביש "משופר" כזה מכיל כ- 1019 יוני נתרן עודפים. כאשר הגביש מתקרר, מרכזי F מתקרבים זה לזה והאלקטרונים שוב מתקשרים ליוני הנתרן. כתוצאה מכך נוצרים בתוך הגביש של מלח בישול חלקיקים קולואידיים של נתרן בעלי קוטר של nm 1-5. החלקיקים האלה מכילים 10 עד 1000 אטומי נתרן אשר בולעים אור בעיקר בטווח צהוב-כתום של הספקטרום (ראו איור). הודות לחלקיקי הנתרן הללו הגבישים של מלח הבישול מקבלים צבע כחול-סגלגל יפה.

ספקטרום בליעה של גביש כחול NaCl
פיק דק משמאל נמצא בחלק UV של ספקטרום ואינו משפיע על הצבע.
פיק רחב בטווח האור הנראה מצביע על כך שבאור הלבן הגביש בולע
בעיקר את הצבעים ירוק, צהוב, כתום ואדום, ואילו הצבעים סגול,
כחול ותכלת עוברים דרך הגביש. הדבר קובע את צבעו של הגביש.
המסת מלח בישול צבעוני נראית כמו להטוט: מהגבישים הכחולים נוצרת תמיסה חסרת צבע לחלוטין!
לפעמים גם למינרל הטבעי של מלח בישול - הליט - יש צבע כחול, סגול או תכלת. גם במקרה זה הסיבה היא נוכחות אטומי הנתרן המתכתי בסריג היוני. אטומי הנתרן נוצרים מיוני הנתרן תחת השפעת הקרינה הנפלטת עקב תהליכים רדיואקטיביים המתרחשים בקליפת כדה"א. אם גביש של הליט מכיל בתוכו גבישים זעירים של חומר רדיואקטיבי, למשל, צירקון (צירקוניום סיליקט, ZrSiO4, שבו תמיד נוכחים יסודות רדיואקטיביים נוספים כגון אורניום או טוריום), אז סביב נתז כזה תמיד נוצר משטח ספירי צבעוני. קוטר הספירה (שהוא בגודל מאיות של מילימטר) מצביע על עומק החדירה של קרני הנפלטות מהחומר הרדיואקטיבי. כתוצאה מפירוק רדיואקטיבי נוצרת שורה של יסודות רדיואקטיביים עוקבים הפולטים קרני . עוצמת האנרגיה של פליטת קרני שונה מיסוד ליסוד, לכן סביב מרכז כזה נוצרות כמה ספירות בעלות קוטר שונה. אם נשבור ונלטש גביש כזה, נראה במיקרוסקופ טבעות זעירות הנקראות טבעות פליוכרויות. על-פי עוצמת הצבע של הטבעות ניתן לקבוע את גילו של מינרל. צבע הטבעת תלוי במספר כולל של חלקיקי שנפלטו והשפיעו על המינרל. לכן ככל שהגביש הוא עתיק יותר כך השפעת הקרינה עליו ממושכת יותר וצבע הטבעת עמוק יותר.
מלח בישול יכול להיות לא רק כחול. במורד הנהר וולגה שברוסיה יש אגמים שבהם מתגבש מלח בישול... אדום! יתרה מכך, לפעמים יש למלח גם ריח נעים וחזק. התופעה הנדירה באה לידי ביטוי בשמות האגמים: ורוד, אדום, ארגמן. כאן היו מפיקים את המלח האדום כבר במאה ה-18: משפחת הצאר אהבה להקסים את אורחיה בזמן הסעודה. האורחים התפלאו וטעמו מהמלח האקזוטי המטובל ב... חיידקים אוהבי מלח - הלופילים (ביוונית philia - אהבה). בהתפתחותם הלופילים מסנתזים פיגמנט אדום-סגלגל. מלח שבו חיים החיידקים מאבד תכונות משמרות שלו: אם ממליחים מזון במלח אדום, הוא מתקלקל מהר מאוד.
מלח בישול מוכר לאנשים זה זמן רב, הוא נושא אותו השם בשפות רבות, מופיע בכינויים של ערים, אגמים, נהרות. זה לא מפתיע - אין חיים ללא מלח בישול. NaCl - המרכיב ההכרחי באורגניזם. גוף של אדם בוגר מכיל מעל 200 ג' NaCl , מהם 45 ג' מומסים בדם. המלח מסייע לפעילות התאים בגוף. בקיבה הופך מלח הבישול לחומצת מלח - בלעדיה לא מתרחש תהליך עיכול. כמות הצריכה היומית של אדם בוגר נעה בין 10-15 ג' נתרן כלורי. מחסור במלח בישול מזיק לבריאות האדם ואף יכול לגרום למותו, ואילו עודף מלח גורם ללחץ דם גבוה ומכביד על פעילות הלב.
להכנת תבשילים אנו משתמשים בסוגים שונים של מלח בישול. עקרת-בית מנוסה יודעת שמלח שולחן דק (שהוא נתרן כלורי נקי מאוד) אינו מתאים במיוחד לכבישת ירקות - דרוש מלח המכיל תוספות של מלחים אחרים, בעיקר של מגנזיום וסידן, אשר משפרים את חדירות הממברנות של תאים ותורמים לזירוז הכבישה, להשבחת הטעם ולפריכות הירקות הכבושים.
באחסון ממושך מתגבש מלח הבישול לכדי גוש מוצק אשר קשה להשתמש בו בבית או בתעשייה. הסיבה לכך בהיגרוסקופיות של המלח (יכולת ספיגת הלחות מן האוויר) - נוצרות טיפות של תמיסת מלח ואלה מדביקות את הגבישים זה לזה חזק מאוד. צורת הגבישים (קוביות) מקלה על התהליך. כדי למנוע היווצרות הגוש ולקבל "מלח רץ", מוסיפים לנתרן כלורי חומרים בעלי יכולת מוגברת לספיגת לחות. החומרים האלה חייבים להיות קשי-תמס, חסרי טעם ולא רעילים - למשל, אבקות דקות של סידן פחמתי (גיר), מגנזיום פחמתי, סיליקט הסידן ועוד. האבקות לא רק סופגות את הלחות, הן גם מכסות את גבישי כלוריד הנתרן ויוצרות על פניהם שכבת מגן דקיקה אשר מונעת את הידבקות הגבישים. בשיטה מורכבת יותר למניעת ההידבקות משנים את צורת הגבישים של נתרן כלורי ע"י אידוי מהיר של תמיסתו, וכך נוצרים גבישים בצורת כוכב. אני עצמי מסתפקת בשיטה של סבתות - מכניסה למלחיה יחד עם מלח הבישול מעט גרגרי אורז אשר מצטיין בספיגת הלחות.
לפעמים מוסיפים למלח בישול אשלגן יודי - כ- 0.01% ממסתו, בין היתר משום שחוסר יוד פוגע בפעילות של בלוטת התריס. יש לציין שאשלגן יודי מתחמצן מהר באוויר לח עד ליוד, לכן מוסיפים לו מייצבים, למשל, גלוקוז או סודה לשתייה.
כמובן, לא ניתן במאמר אחד לספר על התכונות השונות והמשונות של נתרן כלורי. אנסה לפחות להזכיר כמה תכונות מעניינות נוספות של מלח בישול. למשל, בממיסים לא מימיים הוא יוצר תמיסות קולואידיות בעלות צבע צהוב-אדמדם. בלחצים גבוהים מאוד כלוריד הנתרן יכול להוליך זרם חשמלי, למרות שבתנאים רגילים הוא דיאלקטרי. הטעם המלוח שלו אינו קבוע ומשתנה בנוכחות של חומרים אחרים - למשל, הוספת מעט סוכר או העלאת טמפ' מחלישות את טעמו המלוח, ואילו בנוכחות החומצות הטעם מתחזק. לא מזמן קראתי מאמר באחד מהעיתונים המדעים המכובדים בעולם, כי לטעמם של עכברים וארנבים הנתרן הכלורי מלוח יותר מאשר אשלגן כלורי, ואילו במקרה של חתולים המצב הפוך (מעניין אותי לדעת, איך הם סיפרו על כך לאותם המדענים?)
ולקינוח: ניתן לקבל גבישים יפים מאוד מתמיסה המכילה נתרן כלורי וגלוקוז. נוסחת הגבישים -
NaCl*(C6H12O6)2*2H2O שילוב נדיר של מתוק ומלוח!
| ביבליוגרפיה: | ||||||||||||||||||
|
 |
 |
חזרה3 |
 |
הדפסה | ||||||
| החומר במאגר זה הינו לשימוש פרטי ולשימושם של מורים ותלמידים לצרכים לימודיים בלבד. אין להפיץ, להעתיק, לשדר או לפרסם חומר כלשהו מתוך המאגר, ללא הסכמה מראש ובכתב של בעלי זכויות היוצרים השונים, המצויינים בתחתית כל פריט. | |||||||
|
|||||||
| החומר במאגר זה הינו לשימוש פרטי ולשימושם של מורים ותלמידים לצרכים לימודיים בלבד. אין להפיץ, להעתיק, לשדר או לפרסם חומר כלשהו מתוך המאגר, ללא הסכמה מראש ובכתב של בעלי זכויות היוצרים השונים, המצויינים בתחתית כל פריט. |