
|
|
 |
 |
   |
הסדרי נגישות
|
| עמוד הבית > מדעים > רפואה וקידום הבריאות |
|
|||||||||||||||||||||||||||||||||||||||
|
|
עד שנת אלפיים יגיע מספר הנדבקים בנגיף האיידס לכ-40 מיליון איש ואישה, 90% מהם תושבי העולם השלישי, כך צופה ארגון הבריאות הבינלאומי. מאז תוארה המחלה לראשונה באפריקה ובארצות-הברית לפני כ-15 שנים, הולכת מגפת האיידס ומקבלת צביון של מגפה המתפשטת בעיקר בעולם השלישי. על-פי הערכות הארגון הבינלאומי כ-15-18 מיליון בני-אדם נדבקו עד כה בנגיף הקטלני.  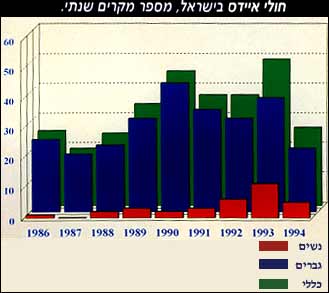 מבין נשאי האיידס בישראל 39% נדבקו ביחסי מין הטרוסקסואליים, 15% נדבקו ביחסי מין הומוסקסואליים, 11% נדבקו כתוצאה מהזרקת סמים, 4% נדבקו בעת לידתם מאימהות נשאיות, 4% חולי המופיליה, 1% נדבקו מעירויי דם מזוהם בנגיף (שניתנו לפני תחילת בדיקות האיידס בישראל), ב-26% סיבת ההדבקה לא נמסרה. מאז 1992 מדווח משרד הבריאות על התווספותם של 150-200 נשאים ונשאיות כל שנה. תרשימים: שרה רוטרו. על-מנת להבין את המערכת החיסונית ואת תגובתה לזיהומים נגיפיים, ניתן להשוות אותה למערכת ההגנתית של מדינת ישראל. לצורך ההשוואה הגדרנו את נושאי התפקידים במערכת החיסונית ואת המקבילים להם במערכת ההגנתית. 1. (virus) נגיף – גרעין הנושא מידע גנטי, המסוגל לנוע בחופשיות תקופה קצרה במחזור הדם, אך אינו מסוגל להשתכפל, אלא אם יחדור לתוך תא חי כלשהו, וישעבד אותו למטרותיו. כלומר הוא חייב פונדקאי על-מנת להתרבות. לצורך ההשוואה – הנגיף הוא האויב. 2. (macrophage) מקרופגים – כדוריות לבנות המשוטטות כל הזמן במערכת הדם וברקמות. תפקידן לזהות, לבלוע ולעכל תאים וגופים מיקרוסקופיים זרים שחדרו לגוף כגון נגיפים, חיידקים, חלקיקי עשן וניקוטין. בזמן העיכול של הנגיף על-ידי הכימיקלים המופרשים עליו בתוך המקרופג, מופיעים נתוני הזיהוי שלו על-גבי קליפתו של המקרופג. באנלוגיה שלנו הללו הם חיילי הבט"ש (בטחון שוטף), המחזיקים את קווי הגבול ומסיירים לאורכם במשך כל תקופות השנה. תפקידם לאתר יחידות אויב חודרות, להיכנס איתם לקרב על-מנת להשמידם, לתפוס שבויים ולחקור אותם על-מנת ללמוד מי הם, ולאיזה יחידות הם שייכים. את המידע הזה עליהם להעביר למפקדות האוגדה שלהם. 3. תאי T מסייעים (helper T cells) – התאים המסייעים/האחראיים – אף הם כדוריות דם לבנות, או בשמן האחר, לימפוציטים, שתפקידן לקבל מהמקרופוגים את זיהוי הנגיף, ולשלוח תאים לוחמים על-מנת לחסלו. במקביל מעבירים התאים המסייעים מידע ללימפוציטים מסוג אחר, תאי ה-B (ראה בהמשך). בהשוואה לצבא, תאי ה-T המסייעים הם מפקדות האוגדות, היושבות בשטח, מקבלות את הנתונים מהיחידות הלוחמות, שולחות כוחות לוחמים מתאימים על-מנת לעצור את כוחות האויב, ובמקביל מעבירות מידע לרפא"ל על מהות הכוחות, וממליצות איזה אמצעי לחימה צריך לפתח על-מנת לעצור את כוחות האויב, ובמקביל מעבירות מידע לרפא"ל על מהות הכוחות, וממליצות איזה אמצעי לחימה צריך לפתח על-מנת לחסלם. כמו כן הן דנות ומחליטות על גיוס יחידות המילואים המתאימות במרכזי הגיוס. 4. (killer T cells) התאים הלוחמים – לימפוציטים המתמחים בחיסול התאים, שהנגיף השתלט עליהם ובחיסול תאים סרטניים. הם מופעלים על-ידי התאים המסייעים/האחראים. באנלוגיה, אלו יחידות העילית הלוחמות – יחידות הקומנדו, המופעלות על-ידי מפקדות האוגדות. 5. (B cells) – תאי B, לימפוציטים היושבים בעיקר בבלוטות הלימפה, ואחראיים על ייצור חומרים ביולוגיים, נוגדנים, שהותאמו במיוחד לחיסול הנגיף הספציפי בעת שהותו הקצרה במחזור הדם. באנלוגיה זהו המרכז לפיתוח אמצעי לחימה (רפא"ל). הוא מקבל את הנתונים על האויב הפולש וסוגי הנשק שלו, אחראי לפיתוח אמצעי נגד מתאימים ולשליחתם לגזרות הלחימה. 6. (antibody) הנוגדנים – מטען ביולוגי, שיוצר במיוחד על-מנת לחסל את הסוג הספציפי של הנגיף, שתכונותיו נלמדו על-ידי תאי ה-B. הנוגדנים זורמים עם הדם, מגיעים לאזור החדירה ועוזרים בחיסול הנגיפים שעוד טרם חדרו לתאים אחרים. כלומר נוגדנים, מאחר שהם אינם תאים, אינם מסוגלים לפגוע בנגיפים שנמצאים בתוך תאים, אלא רק בנגיפים חופשיים חוץ-תאיים. באנלוגיה, הנוגדנים הם יחידות חי"ר המסוגלות להילחם באויב רק כאשר הוא עדיין גלוי, וטרם חדר והשתלט על מוצב או על טנק. הנוגדן אינו מסוגל לחדור לתוך התא, משום שרק תא מסוגל לחסל תא שנכבש. 7. (suppresssor T cell) – לימפוציטים שהם תאי T מפקחים – מנגנון הפיקוח התאי של הגוף היודע לקבוע, שהסכנה חלפה ולהורות למערכת החיסונית לחדול מהתקפה בטרם היא תצא מכלל שליטה. באנלוגיה זהו המטכ"ל, המחליט על הפסקת פעילות הכוחות הלוחמים לאחר ששוכנע שהאויב הושמד. 8. (Memory Cells) – לאחר שהנגיף הוכרע, ממשיכה כמות קטנה של לימפוציטים לסייר במערכת הדם על-מנת לאתר חדירה חוזרת של הנגיף הספציפי אותו למדו לחסל, במטרה לצמצם את זמן התגובה ולחסלו בכוחות בטחון שוטף (בט"ש) המצוידות במודיעין ובנשק המיועדים לסכל את חדירתם של כוחות האויב המוכר. 9. מערכת התקשורת בין סוגי הלימפוציטים השונים מורכבת מחומרים מסיסים, חלבוניים, הנקראים אינטרלוקינים או ציטוקינים. הללו מופרשים על-ידי תאי T מסייעים ותאים אחרים, ותפקידם לעורר לפעילות ולשמש תקשורת בין תאית. החומרים ניתנים למדידה; כמות גדולה יותר שלהם בדם מעידה על פעילות מוגברת של חלק זה או אחר של המערכת החיסונית. המערכת מקבילה למערכת התקשורת בצבא.
לתגובה החיסונית יש ארבעה שלבים: זיהוי האויב, התארגנות להגנה, יציאה להתקפה וחזרה לשגרה. נגיפים חודרים לגוף (יחידות אויב חוצות את הקווים), המקרופגים הנמצאים בדם נתקלים בהם (יחידות הבטחון השוטף נתקלות בהם), המקרופגים בולעים חלק מהם, לומדים את מהותם ומעבירים את הנתונים ללימפוציטים המסייעים (היחידות נכנסות לקרב ראשוני, לוקחות שבויים, חוקרות ומעבירות את המידע למפקדת האוגדה). לאחר שהלימפוציטים המסייעים נכנסו לפעולה הם מתחילים לשכפל את עצמם, ובו זמנית הם ממריצים (באמצעות שדרים, אינטרלוקינים) את שכפולם של הלימפוציטים הלוחמים ושל הלימפוציטים יוצרי הנוגדנים. בינתיים, חדרו נגיפים לתאי הגוף (המקום היחדי בו הם יכולים להשתכפל), התמקמו בהם והחלו לשכפל את עצמם. הלימפוציטים הלוחמים מזהים ומחסלים את התאים שנכבשו על-ידי הנגיפים, ומשמידים אותם באמצעות חומרים כימיים המנקבים את קרומם. הנוזל המקיף את גרעין התא המודבק והמשמש כפונדק השתכפלות לנגיף, נשפך ותהליך השכפול נפסק. בשלב הבא מצטרפים הנוגדנים, שיוצרו על-ידי לימפוציטים מסוג B למלחמה; הם משוטטים בין התאים ועוזרים בחיסול הנגיפים היוצאים מתאים כבושים לאחר ההשתכפלות בדרכם לכבוש תא נוסף. (כוחות המצוידים בנשק מתאים אורבים לחיילים היוצאים מהמוצבים ומכלי הרכב המשוריינים ופוגעים בהם). מאחר שנגיפים משתכפלים אך ורק בתוך תאים ולא בתוך נוזלי הגוף, ומאחר שהם מצויים זמן קצר בלבד בנוזלי הגוף (בצורה חוץ-תאית), לפני שהם פולשים לתאים אחרים, הפעילות החיסונית העיקרית נגדם מתבטאת בפעילות לימפוציטים מסוג NK (התאים הלוחמים) ולא ביצירת נוגדנים, שמעצם טיבם כחלבונים מסיסים, פועלים נגד מיקרואורגניזמים חוץ-תאיים ולא תוך-תאיים. לאחר שהנגיף מוכרע, תאי ה-T המפקחים מאיטים ועוצרים את פעולתם של הנוגדנים, בטרם יצאו מכלל שליטה. במחזור הדם נשארת כמות קטנה של תאים יוצרי נוגדנים, שימשיכו לאורך שנים לטייל במערכת הדם, כשהם בכוננות לאתר ולחסל חדירה מחודשת של נגיפים מאותו הסוג שתקפו. היפה מכל הוא, שהמערכת החיסונית אינה מודרכת ומנוהלת על-ידי המוח, אלא עובדת כמערכת צבאית, בה לכל אחד תפקיד, עם היררכיה ופיקוח ומערכת תקשורת ותגובות למידע. במקביל לכושר הלימוד של הלימפוציטים במערכת החיסון, מפתחים הנגיפים מנגנוני הסחה והתחבאות בפני התאים הממתינים להם. הם עושים זאת בעיקר על-ידי פיתוח מוטציות (שינוי מבנה). נגיפי השפעת המוכרת, למשל, ידועים בכך, שבכל ביקור שנתי הם יופיעו בצורה אחרת ויפתיעו את המערכת החיסונית שלנו בצורתם החדשה, ועד שהגוף לומד להתגבר עליהם, אנחנו סובלים. נגיף האיידס המסוכן מכולם, משתמש באסטרטגיות הסחה שונות על-מנת שלא להתגלות, וזה כולל יצירת מוטציות מרובות. הדבר ההופך את פגיעתו לרעה במיוחד היא יכולתו לחדור ישירות לתוך הלימפוציטים, helper T cells, תאי ה-T המסייעים. תאים אלו אחראים על תפעול המערכת החיסונית במניעת שכפל הנגיף מתבטאת בזיהוי תאי ה-T המודבקים כתאים זרים, ואז מתחיל הרס עצמי של מערכת החיסון. (אוטואימוניות). מגפת האיידס מותירה בשוליה שובל עצום של נשאים שלא פיתחו עדיין את המחלה, וחולים בשלבים שונים של המחלה. אף-על-פי שברור שרוב הנשאים יפתחו את מחלת האיידס בזמן זה או אחר, מרבית החידושים בשטח הטיפול התרופתי במחלת האיידס רלבנטיים לקבוצת הנשאים והחולים, ומטרתם הארכת החיים ושיפור איכותם.
בשנת 1996 מתמקד מחקר האיידס בשני כיוונים: האחד, פיתוח תרופות שתאטנה את התפתחות המחלה, והשני, פיתוח חיסון לאיידס. השאלה הגדולה היא, האם יצליחו התרופות החדשות והקיימות להאט את קצב התפתחות המחלה ולעצור את הכשל החיסוני, העומד במרכז תמונת מחלת האיידס. במחקרים שפורסמו בתחילת השנה מסתבר שנגיף האיידס, החבוי בתוך תאי מערכת החיסון, הלימפוציטים המסייעים (helper T cells) ונחשב תמיד כנגיף בעל כושר התרבות איטי, איננו כזה כלל ועיקר. ממודלים מתימטיים מסתבר שהנגיף עובר התחלקות מהירה ביותר וקבועה בכל שלבי המחלה, דבר שמלווה בהרס מסיבי וקבוע של כשני ביליון לימפוציטים מסייעים ביממה. מהממצא הזה עולה, שעל-מנת לשמר את יציבות תפקודה של מערכת החיסון, יש צורך ביצירת שיווי-משקל בין ההרס שלה לבין בנייתה מחדש וזאת, כנראה, על-ידי אספקת לימפוציטים חדשים לבלוטות הלימפה, ששוב מותקפים ונהרסים על-ידי נגיף האיידס. הפרתו של שיווי-המשקל הזה, כלומר הרס רב יותר של תאי מערכת החיסון לעומת היכולת לספק תאים חדשים למערכת, גורמת בסופו של דבר, לכשל חיסוני הדרגתי, המתבטא בירידה בריכוז תאי מערכת החיסון התאית בגוף, ובחשיפת הגוף למזהמים שונים בהם מטפלת מערכת החיסון התקינה.
בשנים האחרונות התגלה שנגיפי האיידס בעולם שונים במבנה מעטפתם. בדגימות של נגיפי איידס שנלקחו מרחבי העולם, מסתבר שקיימים מספר תתי-זנים של הנגיף, כשכל תת זן מתאפיין ברצפים זהים של חלבונים באתרים ספציפיים על-פני מעטפת הנגיף. בעולם זוהו עד היום שבעה תתי זנים לנגיף: G,F,E,D,C,B.A. למרות שעדיין לא הוכחה חשיבותם הביולוגית, מורים ממצאים ממספר מעבדות, שזנים שונים מתאפיינים בהתבייתות שונה לסוגי תאים שונים במערכת החיסון, ייתכן שהדבר משפיע על קלות ההדבקה בנגיף. לדוגמה, תת-זן E מדרום-מזרח אסיה מתביית במעבדה בקלות יתר על תאי חיסון מסוג מקרופגים ותאי לנגרהנס הנמצאים בריכוז גבוה באברי המין הנקביים והזכריים. לעומת זאת תת-זן B מתביית ביתר קלות על לימפוציטים מסייעים סוג (helper T cells) המצויים בריכוז גבוה בבלוטות הלימפה ובמחזור הדם ולא באברי המין. שוני זה בהתבייתות תתי-זנים יכול להסביר את השוני בדרכי התפשטות הנגיף באזורי העולם השונים: התפשטות הנגיף דרך יחסי מין הטרוסקסואליים שכיחה ביותר בדרום-מזרח אסיה, שם ברקע רוב ההידבקויות עומד נגיף המתביית על ריריות אברי המין. לעומת זאת בארצות המערב שכיחה התפשטות הנגיף במגע עם דם מזוהם או ריריות מדממות (למשל אצל נרקומנים שמזריקים סמים, או הומוסקסואלים שאצלם נפצעת ומדממת רירית הרקטום בזמן מגע מיני הומוסקסואלי), שם נפוץ נגיף המתביית בעיקר על לימפוציטים מסייעים (helper T cells) במחזור הדם. במחקר שהסתיים לאחרונה בבית-חולים הדסה נמצא, שבישראל קיימים ארבעה תתי-זנים של נגיף האיידס: מרבית הנשאים והחולים ההומוסקסואלים והנרקומנים נדבקו בתת-זן B ומיעוטם בתתי-זן A ו-D, בקרב תושבים פלסטינאים מארצות המפרץ זוהו תתי הזנים A ו-D. לעומתם נדבקו רוב הנשאים מאתיופיה החיים בישראל בתת-הזן האפריקאי מסוג C. השאלה המחקרית הנובעת מכך היא, האם ההידבקות בנגיף מנשאים בהם תת הנגיף C תהיה שונה במהותה ובקצבה מהידבקות מנשאים, שנדבקו בנגיף מתת-הזן B. שאלה זו נבדקת במחקר שמתבצע כיום בישראל. 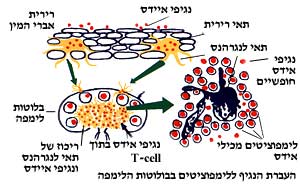
נושא מחקרי המקבל תאוצה בשנים האחרונות הוא בדיקת חשיבותה של השפעת הסביבה על תפקוד מערכת החיסון בשנים שבהן היא חשופה לנגיף האיידס. לאחרונה נחקרת מערכת החיסון בקבוצות קטנות וייחודיות של נשאים שנחשפו לנגיף אך לא נדבקו בו, בקבוצות שנדבקו בנגיף אך לא פיתחו כשל חיסוני גם 15 שנה לאחר ההדבקה ובמספר תינוקות, שהבריאו כליל מזיהום טבעי בנגיף שנרכש בזמן הלידה. מחקר בשלוש הקבוצות הייחודיות האלו, המייצגות עדיין מיעוט קטן של אנשים שנדבקו בנגיף, יצביע אולי על תפקיד ייחודי של מערכת החיסון או על אפשרות, שנגיף האיידס פיתח מוטציות שהפכו אותו לאלים פחות למערכת החיסון, בדומה לנגיף איידס של הקופים באפריקה שלא גורם לכשל חיסוני בקופים. מחקרים שנערכים בארץ במרכז האיידס בבית-חולים קפלן, מנסים לתת תשובה לשאלה, מהם התהליכים הפנימיים במערכת החיסון שנוצרים עקב החשיפה לנגיף, בסביבות גיאוגרפיות שונות, ועד כמה חשובים התהליכים הללו בהתפתחות הכשל החיסוני. ממצא מחקרי מעניין עליו דווח לאחרונה העלה, שבעקבות טיפול בפרזיטי מעיים באוכלוסיות שנדבקו בנגיף האיידס באפריקה, יורדת מידת השפעול הכוללת של מערכת החיסון. הדבר מעורר את השאלה, האם לעובדה זו חשיבות במידת קלות ההדבקות בנגיף או בקצב התפתחות המחלה.
התרופה הראשונה נגד איידס, AZT, היא חומצת גרעין (נוקליאוזיד) שגויה (נוסחה גנטית שגויה במכוון). התרופה נכנסה לשימוש בשנת 1985. פעולתה של התרופה הזו מתבטאת בעיכוב האנזים (חלבון המאיץ פעילות כימית בגוף (RT) Reverse transcriptase הנמצא בנגיף האיידס, שתפקידו שחלוף החומר הגנטי בנגיף האיידס מ-RNA ל-DNA . (ה-RNA כמו ה-DNA מורכב מרצפים של חומצות גרעין. ה-RNA הנגיפי מתפרק לגורמיו ומורכב מחדש כמו פאזל על-ידי האנזים RT. וההרכבה נעצרת אם אחת מאבני הפאזל אינה מתאימה. במקרה זה, חומצת גרעין במבנה שגוי.) כתוצאה מעיכוב השחלוף מתפרק הנגיף וריכוזו בדם יורד בצורה דרסטית למשך מספר חודשים. עובדה זו מתורגמת לשיפור קליני בנוטלי התרופה. אך נגיף האיידס מפתח במשך הזמן עמידות הולכת וגדלה לתרופה על-ידי חמש מוטציות נקודיות בחלבון האנזים RT. בשטח מתבטא הדבר בהיעלמות האפקט התרופתי הקליני. במחקרים נוספים התברר ש-AZT איננה יעילה בשלבי המחלה הראשונים, הא-סימפטומטים. בסוף שנות השמונים הגיעו תרופות נוספות לכלל פיתוח וניסויים קליניים. התרופות הללו, ddC ו-ddI שאף הן חומצות נוקליאיות (נוקלאוזידים) שגויות הועילו אך מעט כשניתנו כמונותרפיה (תרופה אחת), וגם בהן נצפתה היווצרות עמידות מעבדתית וקלינית עקב מוטציות נקודתיות באנזים RT. המשך המחקר הוביל לניסויים בהם הוכח, ששילובי שתי תרופות נוקלואוזידיות מאט את קצב היווצרות נגיף עמיד. עובדה זו תורגמה מיד לניסויים נוספים, שהוכיחו שהתמותה מהמחלה וקצב הידרדרות תפקוד מערכת החיסון היו פחותים באופן משמעותי בחולים שטופלו בשילוב של שתי תרופות, לעומת אלו שקיבלו תרופה אחת. כך נפתחה תקופת הטיפולים המשולבים שעיקרם התקפה מתוכננת היטב על אתר המטרה – האנזים הנגיפי Reverse transcriptase. אנזים שמועד להתפתחות מוטציות בהשפעת התרופות הנוקלואוזידיות. שילובי תרופות כנגד נגיף האיידס ניתנים כיום לנשאי הנגיף, שבבדיקות דם הסתבר שדרגת הכשל החיסוני שלהם גבוהה, כלומר, תפקוד מערכת החיסון התאית (ריכוז תאי T מסייעים) הוא בסדר גודל של 30%-40% בלבד. המצב האידיאלי אליו שואפים מפתחי התרופות הוא מציאת שילוב נוקליאוזידים כזה, שיגרום להיווצרות מוטציות באנזים RT, שיביאו לביטול התפתחות העמידות לתרופה AZT. לאחרונה פורסמו ממצאי מחקר בו נעשה השימוש בתרופה הנוקלואוזידית החדשה 3TC. נמצא, ששילוב התרופות 3TC ו-AZT יצר בתנאי מעבדה מצב שבו לא התפתחה כלל עמידות נגיף האיידס לתרופה AZT, או במקרה שהעמידות הייתה קיימת כמקודם – היא התבטלה. קבוצה נוספת של תרופות הבשילו בשלוש שנים האחרונות למחקר קליני: אלו תרופות המעכבות את פעילות האנזימים המעכלים חלבונים Protease inhibitors (פרוטיאזה-אנזים שמעכל חלבונים). פעילותן מתבצעת בחלק הנוזלי (ציטופלסמה) של התא הנגוע בנגיף בשלב שאחרי תרגום הקוד הגנטי של הנגיף בעת יצירת חלבוניו. מעכבי פרוטיאזות גורמים לכך, שתהליך עטיפת הנגיף החדש על-ידי חלבוניו נפגם, וכך נוצר נגיף דפקטיבי. שלוש תרופות נמצאות בניסויים מתקדמים: SAQUINAVIR, RITONAVIR, וה-.INDINAVIR. ניסויים קליניים בשילוב שלוש תרופות, שאחת מהן מעכבת את אנזימי הפרוטיאזות ושתיים מעכבות את ה-RT, נערכים במטרה לראות אם שלוש תרופות ישיגו יעילות קלינית גבוהה יותר משתי תרופות, והאם יתבטא הדבר גם בהתפתחות איטית יותר של מוטציות נגיפיות. מתוצאות ראשונות מסתבר ששילוב שלוש התרופות מוריד את רמת נגיף האיידס באופן דרסטי לתקופות ארוכות ביותר במטופלים. התקווה והרצון למצוא חיסון לאיידס עדיין רחוקים ככל הנראה ממימוש. ניסיונות חיסון מרובים בחיות מעבדה, בעיקר בקופים, בחמש השנים האחרונות נכשלו. הסיבות לכישלון נעוצות בעיקר בעובדות הבאות: נגיף האיידס הוא נגיף תוך-תאי, המתפשט מתא לתא עם מעט חשיפה לנוגדנים, שהם חלבונים המשפיעים על מיקרואורגניזמים חוץ-תאיים. בנוסף, נגיף האיידס מפתח מוטציות מרובות. כתוצאה מכך, הזרקת חיסון נגד האיידס, המופק מתת-זן אחד של הנגיף, לא מגן מפני זיהום בתת-זן אחר, שלא מזוהה באופן עקבי על-ידי מערכת הנוגדנים, זאת למרות התפתחות נוגדנים לזן בו נעשה שימוש כחיסון. במספר מחקרי שדה בחיסוני איידס שכבר נערכו בארצות-הברית נמצא, שמידת ההדבקה שחלה למרות מתן החיסון הייתה גבוהה (אם כי פחותה מקבוצת ביקורת שלא קיבלה חיסון). בעקבות כשלונות קליניים אלו נעצרו התכניות למבצעי חיסון ניסיוניים נרחבים בתאילנד, בברזיל ובאפריקה. כיום נראה, שהמחקר למציאת חיסון כנגד איידס עומד להשתנות באופן קונספואלי. מחיסון המבוסס על תגובה נוגדנית, לחיסון המבוסס על שינויים במנגנון התגובתי התאי (צלולרי). הקונספט של החיסון התאי מבוסס על מבנה מנגנון מערכת החיסון, שנצפה באנשים שנחשפו לנגיף האיידס אך לא נדבקו וכן על תוצאות ניסויים שנערכו בקופים. ניסויים בחיסון חדשני שנערכו בקופים, הראו שהחדרת כמות מזערית של נגיף האיידס בצורה תוך-רקטלית לקוף, גרמה לעלייה ניכרת ברמת שפעול מערכת החיסון התאית ולעלייה ברמת לימפוקינים מסוימים. בהמשך הניסוי הוזרק נגיף אלים לקוף המחוסן. קוף זה לא נדבק, והגנתו נגרמה כתוצאה משפעול מערכת החיסון התאית. ראוי לציין, שבקוף המחוסן לא התעוררו כלל נוגדנים כנגד הנגיף המוזרק. האם זהו הכיוון העתידי בהתפתחות חיסונים כנגד איידס? * ד"ר שלמה מעיין, מנהל המרפאה לאיידס, בית-חולים הדסה עין-כרם.
|
|||||||||||||||||||||||||||||||||||||||
 |
|
|||||||||||||||||||||||||||||||||||||||
| 123 |